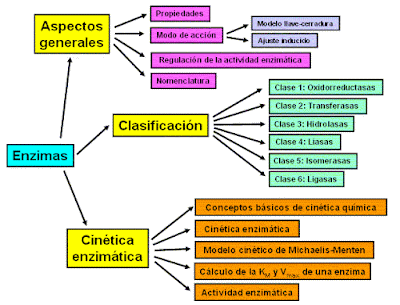
ENZIMAS
Los enzimas son biomoléculas especializadas en la catálisis de las reacciones químicas que tienen lugar en la célula. Son muy eficaces como catalizadores ya que son capaces de aumentar la velocidad de las reacciones químicas mucho más que cualquier catalizador artificial conocido, y además son altamente específicos ya que cada uno de ellos induce la transformación de un sólo tipo de sustancia y no de otras que se puedan encontrar en el medio de reacción.
Desde el punto de vista químico, las enzimas están formadas de carbono (C), Hidrogeno (H), oxigeno (O), Nitrógeno (Ni), y Azufre (S) combinados, pero siempre con peso molecular bastante elevado y común propiedades catálicas especificas. Su importancia es tal que puede considerarse la vida como un "orden sistemático de enzimas funcionales". Cuando este orden y su sistema funcional son alterados de algún modo, cada organismo sufre mas o menos gravemente y el trastorno puede ser motivado tanto por la falta de acción como por un exceso de actividad de enzima.
Las enzimas son catalizadores de naturaleza proteínica que regulan la velocidad a la cual se realizan los procesos fisiológicos, producidos por los organismos vivos. En consecuencia, las deficiencias en la función enzimática causan patologías.
A, partir de entonces fueron aisladas otras enzimas en forma pura, cristalina, y el análisis demostraba siempre la presencia de una proteína, simple o conjugada. Cuando los análisis químicos demuestran que la enzima es una proteína conjugada, pueden distinguirse en el dos partes bien diferenciadas:
- El grupo prosteico (Coenzima)
- La proteína (Apoenzima)
- Solo proteínas, que difieren entre si por la secuencia con que los aminoácidos están combinados, como la ureasa y las enzimas digestivas (la pepsina y la tripsina)
- Los conjugados, separados en dos entidades químicas bien definidas: la coenzima y la apoenzima.
Al final de sus y trabajos, clasifico las enzimas en seis grupos principales, correspondientes por sus términos a las raciones que cada enzima ejerce sobre el sustrato. Estos grupos se subdividen en otro, según el tipo de sustrato y los átomos concretos que son sensibles a sus acciones. Estos seis grupos son los siguientes:
- Oxidoreductasas
- Transferasas
- Hidrolasas
- Isomerasa
- Liasas
- Ligasas

La teoría cinética química establece que las reacciones químicas transcurren molécula a molécula de modo que una reacción tal como:
R (reactivos) → P (productos) tiene lugar porque una determinada fracción de la población de moléculas R, en un instante dado, posee energía suficiente como para alcanzar un estado activado llamado estado de transición, en el que es muy fácil que se rompan o se formen uno o más enlaces químicos para formar los productos P. Es frecuente confundir el estado de transición con un intermediario de reacción; sin embargo este estado no es ninguna especie química concreta, sino que podría definirse con más exactitud como un "momento molecular fugaz", altamente inestable, en el que uno o más enlaces químicos están muy próximos a romperse o a formarse.
La velocidad de una reacción química es proporcional al número de moléculas por unidad de tiempo con energía suficiente para alcanzar el estado de transición. Este estado de transición posee una energía superior a la de los reactivos y a la de los productos constituyendo entre ellos una barrera energética que debe superarse para que la reacción tenga lugar. La diferencia entre la energía de los reactivos y la del estado de transición recibe el nombre de energía libre de activación.
La cinética enzimática estudia la velocidad de las reacciones catalizadas por enzimas. Estos estudios proporcionan información directa acerca del mecanismo de la reacción catalítica y de la especifidad del enzima. La velocidad de una reacción catalizada por un enzima puede medirse con relativa facilidad, ya que en muchos casos no es necesario purificar o aislar el enzima. La medida se realiza siempre en las condiciones óptimas de pH, temperatura, presencia de cofactores, etc, y se utilizan concentraciones saturantes de sustrato. En estas condiciones, la velocidad de reacción observada es la velocidad máxima (Vmax). La velocidad puede determinarse bien midiendo la aparición de los productos o la desaparición de los reactivos.
Al seguir la velocidad de aparición de producto (o de desaparición del sustrato) en función del tiempo se obtiene la llamada curva de avance de la reacción, o simplemente, la cinética de la reacción. A medida que la reacción transcurre, la velocidad de acumulación del producto va disminuyendo porque se va consumiendo el sustrato de la reacción (Figura de la derecha). Para evitar esta complicación se procede a medir la velocidad inicial de la reacción (v0). La velocidad inicial de la reacción es igual a la pendiente de la curva de avance a tiempo cero (Figura de la derecha). De esta forma, la medida de v0 se realiza antes de que se consuma el 10% del total del sustrato, de forma que pueda considerarse la [S] como esencialmente constante a lo largo del experimento. Además, en estas condiciones no es necesario considerar la reacción inversa, ya que la cantidad de producto formada es tan pequeña que la reacción inversa apenas ocurre. De esta forma se simplifican enormemente las ecuaciones de velocidad.
Para estudiar la cinética enzimática se mide el efecto de la concentración inicial de sustrato sobre la velocidad inicial de la reacción, manteniendo la cantidad de enzima constante. Si representamos v0 frente a [S]0 obtenemos una gráfica como la de la Figura de la derecha. Cuando [S]0 es pequeña, la velocidad inicial es directamente proporcional a la concentración de sustrato, y por tanto, la reacción es de primer orden. A altas [S]0, el enzima se encuentra saturada por el sustrato, y la velocidad ya no depende de [S]0. En este punto, la reacción es de orden cero y la velocidad es máxima (Vmax).
Ecuación Michaelis-Menten
Los estudios sistemáticos del efecto de la concentración inical del sustrato sobre la actividad enzimática comenzaron a realizarse a finales del siglo XIX. Ya en 1882 se introdujo el concepto del complejo enzima-sustrato como intermediario del proceso de catálisis enzimática. En 1913, Leonor Michaelis y Maud Menten desarrollaron esta teoría y propusieron una ecuación de velocidad que explica el comportamiento cinético de los enzimas.
Para explicar la relación observada entre la velocidad inicial (v0) y la concentración inicial de sustrato ([S]0) Michaelis y Menten propusieron que las reacciones catalizadas enzimáticamente ocurren en dos etapas: En la primera etapa se forma el complejo enzima-sustrato y en la segunda, el complejo enzima-sustrato da lugar a la formación del producto, liberando el enzima libre
|
En este esquema, k1, k2 y k3 son las constantes cinéticas individuales de cada proceso y también reciben el nombre de constantes microscópicas de velocidad. Según esto, podemos afirmar que:
- v1 = k1 [E] [S]
- v2 = k2 [ES]
- v3 = k3 [ES]
Se puede distinguir entre enzima libre (E) y enzima unido al sustrato (ES), de forma que la concentración total de enzima, [ET], (que es constante a lo largo de la reacción) es:
[ET] = [E] + [ES]
Como [E] = [ET] - [ES], resulta que: v1= k1[S] [ET] - k1 [S] [ES]
|
Este modelo cinético adopta la hipótesis del estado estacionario, según la cual la concentración del complejo enzima-sustrato es pequeña y constante a lo largo de la reacción (Figura de la derecha). Por tanto, la velocidad de formación del complejo enzima-sustrato (v1) es igual a la de su disociación (v2+ v3):
v1 = v2 + v3
Además, como [ES] es constante, la velocidad de formación de los productos es constante:
v = v3 = k3 [ES] = constante.
Como v1=v2+v3, podemos decir que:
k1[S] [ET] - k1 [S] [ES] = k2 [ES] + k3 [ES]
Despejando [ES], queda que:  , siendo
, siendo  , en donde la expresión (k2+k3)/k1 se ha sustituído por KM, o constante de Michaelis-Menten. Este enlace nos aporta una explicación sobre las razones que hacen de la KM un parámetro cinético importante.
, en donde la expresión (k2+k3)/k1 se ha sustituído por KM, o constante de Michaelis-Menten. Este enlace nos aporta una explicación sobre las razones que hacen de la KM un parámetro cinético importante.
Por lo tanto, en el estado estacionario, la velocidad de formación del producto es:
v = v3 = k3 [ES] =
|
Para cualquier reacción enzimática, [ET], k3 y KM son constantes. Vamos a considerar dos casos extremos:
Si introducimos el parámetro Vmax en la ecuación general de la velocidad, (la fórmula recuadrada anteriormente), obtenemos la expresión más conocida de la ecuación de Michaelis-Menten:
|
Hay enzimas que no obedecen la ecuación de Michaelis-Menten. Se dice que su cinética no es Michaeliana. Esto ocurre con los enzimas alostéricos, cuya gráfica v frente a [S] no es una hipérbola, sino una sigmoide (Figura de la derecha). En la cinética sigmoidea, pequeñas variaciones en la [S] en una zona crítica (cercana a la KM) se traduce en grandes variaciones en la velocidad de reacción.
Reacciones multisustrato
Cuando una enzima une dos o más sustratos y libera múltiples productos, el orden de los pasos para a ser una característica importante del mecanismo de reacción.
Hay distintos mecanismos que explican este tipo de reacciones, veamos varios casos en los que se utilicen dos sustratos S1 y S2 y se obtengan dos productos P1 y P2.
a)Unión ordenada de los sustratos: en este caso un sustrato debe unirse antes de que el segundo sustrato pueda unirse a la enzima.
b) Unión aleatoria de los sustratos: en este caso cualquiera de los dos sustratos puede ser el primero en unirse a la enzim
c) Mecanismo “ping-pong”: en este caso primero se une un sustrato, se libera el primer producto, y a continuación se une el segundo sustrato para así liberar el segundo producto.
Inhibición enzimática
Existen sustancias que pueden impedir que la enzima desarrolle su actividad catalítica, ralentizando o paralizando la reacción enzimática. A estas sustancias se las denomina inhibidores enzimáticos. Teniendo en cuenta que las reacciones químicas en la célula están catalizadas por enzimas, es fácil intuir el papel de muchos inhibidores enzimáticos que actúan como fármacos, antibióticos o conservantes; otros pueden ser tóxicos, potentes venenos. Por ejemplo, la aspirina (acetilsalicilato) es un analgésico que inhibe la enzima que cataliza el primer paso en la síntesis de prostaglandinas, implicadas en la producción del dolor.
Se conocen dos tipos principales de inhibición: la reversible y a la irreversible. La primera implica una unión “no covalente” del inhibidor y, por lo tanto, siempre puede revertirse. En la inhibición irreversible, el inhibidor se une al enzima de forma “covalente” y permanente.
Inhibición reversible: los distintos modelos de inhibición reversible implican la unión no covalente del inhibidor con la enzima, pero difieren en los mecanismos por medio de los cuales reducen la actividad enzimática y en la forma en que afectan a la cinética de la reacción. Entre ellos están la inhibición competitiva, la acompetitiva y la no competitiva.
Regulación enzimática
Una característica que diferencia las enzimas de los catalizadores químicos convencionales es su capacidad para regular su propia actividad. Una enzima puede ser más o menos activa gracias a la existencia de distintos niveles de regulación:
Nivel de síntesis: implica una regulación genética, en este caso se trata de proteínas inducibles que se sintetizan cuando las requiere el organismo.
Nivel de actividad: que las moléculas de enzima existentes estén más o menos activas. Puede llevarse a cabo por factores extrínsecos a la enzima. Dicha regulación puede venir dada por una variación en la concentración celular del sustrato o de inhibidor, como se ha indicado en apartados anteriores, o bien, por cambios de temperatura o de pH, en este caso se debe a que las enzimas poseen un pH óptimo y una temperatura óptima de trabajo.
La variación del pH o la Tª afectan a la actividad enzimática, en algunos casos, como los de la figura los efectos pueden ser bastante drásticos, mientras que en otros casos el rango de Tª o pH optimo puede ser mayor, sin que afecten a la actividad. No obstante, suele ocurrir que una vez superado el óptimo se produzca una desnaturalización irreversible de la enzima
También ocurre que la regulación puede ser provocada por factores intrínsecos a la propia enzima; en este caso se habla de enzimas reguladoras, enzimas que por su propia naturaleza tienen mecanismos especiales de regulación. Están especializadas en regularse respondiendo de forma muy sensible a señales externas. En la célula las enzimas operan en grupo, en rutas constituidas por varios pasos enzimáticos. En cada ruta hay al menos una enzima reguladora que determina la velocidad de toda la ruta. La modulación de las enzimas reguladoras ocurre mediante diferentes mecanismos:
Enzimas alostéricas: Funcionan mediante la unión reversible no covalente de compuestos regulatorios llamados moduladores. El modulador puede ser una activador (modulación positiva) que acelere el proceso, o un inhibidor (modulador negativo). Este modulador puede se el propio sustrato de la reacción (alosterismo homotrópico) o una otra sustancia (alsoterismos heterotrópico). Normalmente se trata de enzimas multiméricas, de tal forma que la entrada del primer sustrato facilita (acelera) la entra del siguiente, y normalmente ocurre que el sito activo y el regulatorio se encuentran en distintas subunidades. En esos casos la cinética que presenta la enzima es distinta a la clásica de Michaelis-Menten, apareciendo una sigmoide como muestra la siguiente figura:
Enzimas interconvertibles: Se trata de enzimas reguladoras en las que el proceso de control de la actividad se realiza gracias a una modificación covalente reversible, en el que están implicadas también otras enzimas que se encargan de hacer la modificación, en base a la concentración celular de determinados metabolitos. Un ejemplo, claro es el caso de la enzima piruvato deshidrogenasa, que se estudiará en profundidad en el Tema 14, y que su regulación implica, entre otros factores, la fosforilación /defosforilación de la enzima. De tal forma que cuando la enzima es fofosforilada pierde su actividad y cuando se defosforila recupera su actividad.
















No hay comentarios:
Publicar un comentario