AGUA
La vida en la tierra se
suele describir como un fenómeno basado en el carbono, pero sería igualmente
correcto llamarlo un fenómeno basado en el agua. Es probable que la vida se ha
originado en el agua, hace más de tres mil millones de años, y que todas las
células vivientes sigan dependiendo del agua para existir. En la mayor parte de
las células el agua es la molécula más importante y forma de 60 a 90% de su masa, aunque hay
pocas excepciones, como las semillas y las esporas, de las cuales se expulsa el
agua.
La molécula de agua tiene
forma de V, y el ángulo entre los dos enlaces covalentes O—H es de 104.5˚.
Algunas propiedades importantes del agua se deben a la forma angulada y a los enlaces
intermoleculares que pueden formar.
El agua es un excelente solvente,
ya que posee una viscosidad intrínseca que no impide mucho el movimiento de las moléculas
disueltas en ella. Por último, las moléculas mismas de agua son pequeñas en
comparación con las de otros solventes como el etanol y el benceno.
El pequeño tamaño de las
moléculas de agua determina que muchas
de ellas puedan asociarse con partículas de soluto y hacerlas más solubles.
Las sustancias iónicas y polares se disuelven en
agua: la ionización se relaciona con la ganancia o pérdida de un electrón, que
da lugar a un átomo o a un compuesto que presenta carga neta. Las moléculas que
se pueden disociar y formar iones se llaman electrolitos. Las sustancias que se
disuelven con facilidad en agua se llaman hidrófilicos o amantes del agua.
Concentraciones
celulares y difusión: el
comportamiento de los solutos en el citoplasma es distinto del que
tienen en una sencilla solución en agua. Una de las diferencias más importantes
es la reducción de la velocidad de difusión dentro de las células.
Presión
osmótica: Si una membrana permeable al solvente separa a dos
soluciones que contienen concentraciones distintas de sustancias disueltas, o
solutos, las moléculas del solvente se difundirán desde la solución menos
concentrada hacia la más concentrada en un proceso llamado osmosis. La presión
necesaria para evitar este flujo de solvente se llama presión osmótica. La
presión osmótica de una solución depende de la concentración molar total del
soluto y o de su naturaleza química.
Se dice que las moléculas
no polares son hidrofóbicas (que “odian” al agua) y a este efecto de exclusión
de sustancias no polares por parte del agua se le llama efecto hidrofóbico. El
efecto hidrofóbico es crítico para el plegamiento de las proteínas y el
autoensamblaje de las membranas biológicas.
Interacciones
no covalentes
Interacciones
carga-carga: son interacciones electrostáticas entre
dos partículas cargadas. Esas interacciones son potencialmente las fuerzas no
covalentes más grandes y se pueden extender a mayores distancias que otras interacciones
no covalentes.
Puentes
de Hidrogeno en el agua: Una de las consecuencias importantes
de la polaridad de la molécula de agua es que dichas moléculas se atraen entre
sí. La atracción entre uno de los átomos de hidrogeno, ligeramente positivo, de
una molécula de agua y los pares de electrones parcialmente negativos en uno de
los orbitales híbridos sp3, produce un “puente de hidrogeno”. En un puente de
hidrogeno entre dos moléculas de agua, el átomo de hidrogeno permanece enlazado
covalentemente a su átomo de oxigeno que es el donador de hidrogeno. Al mismo
tiempo, está unido a otro átomo de oxígeno, llamado aceptor de hidrogeno.
Fuerzas
de Van der Waals: Otra fuerza débil a las interacciones
entre los dipolos permanentes de dos enlaces polarizados sin carga, o las
interacciones entre dipolo permanente y un dipolo transitorio, inducido en una
molécula vecina. Esas fuerzas son de corto alcance y su magnitud es pequeña, de
unos 1.3KJ mol-1 y 0.8KJ mol-1.
Interacciones
Hidrofóbicas: La asociación de una molécula o grupo
relativamente no polar con otras moléculas no polares. Si bien a las
interacciones hidrofóbicas a veces se le llaman “enlaces” esta descripción es
incorrecta. Las moléculas o grupos no polares tienden agregarse en solución
acuosa no por la atracción mutua sino porque las moléculas polares de agua
atrapadas en torno a los compuestos no polares tienden asociarse entre sí y no
con las moléculas no polares.
Ionización
del agua
Una de las propiedades
importantes del agua es su pequeña tendencia a ionizarse. El agua pura no está
formada solo por H2O, sino también por una baja concentración de
iones hidronio H3O y una concentración igual de iones hidróxido OH.
Los iones hidronio e hidróxidos se forman por un ataque nucleofilico del
oxígeno contra uno de los protones en una molécula adyacente de agua.
Importancia
Biológica del agua
1. Participa
en las reacciones que se dan en nuestro cuerpo.
2. Es
transportadora de nutrientes para que las células e alimenten.
3. Es
importante para eliminar desechos tóxicos del cuerpo.
4. Hay
un 65% o más en nuestro cuerpo.
pH
El pH es una
medida de acidez o alcalinidad de una disolución. El pH indica la concentración
de iones hidrogeno [H]+ presentes en determinadas disoluciones.
pH = –log[H+]
Disoluciones
amortiguadoras
Diversas
reacciones químicas que se generan en disolución acuosa necesitan que el pH del
sistema se mantenga constante, para evitar que ocurran otras reacciones no
deseadas. Las disoluciones reguladoras, amortiguadoras o búfer, son capaces de
mantener la acidez o basicidad de un sistema dentro de un intervalo reducido de
pH.
Estas disoluciones
contienen como especies predominantes, un par ácido/base conjugado en
concentraciones apreciables. La capacidad reguladora que posea la disolución
depende de la cantidad presente del ácido débil y su base débil conjugada,
mientras mayor sea esta cantidad, mayor será la efectividad de dicha
disolución. El que sean ácidos y bases débiles significa que actúan como
electrólitos débiles, en pocas palabras, no se ionizan por completo en agua. La
reacción de neutralización es una reacción entre un ácido y una base.
Generalmente en las reacciones acuosas ácido-base se generan agua y una sal.
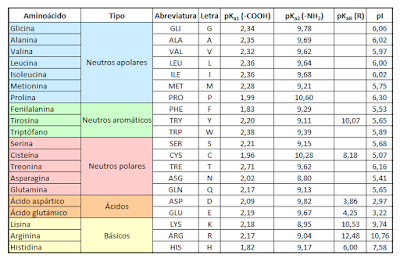
AMINOÁCIDOS
Los aminoácidos son la
base de todo proceso vital ya que son absolutamente necesarios en todos los
procesos metabólicos. Sus funciones más importante son el transporte óptimo de
nutrientes y la optimización del almacenamiento de todos los nutrientes (es decir,
agua, grasas, carbohidratos, proteínas, minerales y vitaminas).
Un aminoácido es una
molécula orgánica con un grupo amino (-NH2) y un grupo carboxilo (-COOH).1 Los
aminoácidos más frecuentes y de mayor interés son aquellos que forman parte de
las proteínas. Dos aminoácidos se combinan en una reacción de condensación entre
el grupo amino de uno y el carboxilo del otro, liberándose una molécula de agua
y formando un enlace amida que se denomina enlace peptídico; estos dos
"residuos" de aminoácido forman un dipéptido. Si se une un tercer
aminoácido se forma un tripéptido y así, sucesivamente, hasta formar un
polipéptido.
Los
aminoácidos esenciales son aquellos que el propio organismo
no puede sintetizar por sí mismo. Esto implica que la única fuente de estos
aminoácidos en esos organismos es la ingesta directa a través de la dieta. Las
rutas para la obtención de los aminoácidos esenciales suelen ser largas y
energéticamente costosas.
Los
aminoácidos no esenciales son todos aminoácidos que el cuerpo
los puede sintetizar, y que no necesita hacer la ingesta directa en una dieta.
REACCIONES
GENERALES DE AMINOÁCIDOS:
Transaminación, desanimación y descarboxilación
Estos son los tres tipos de reacciones más generales
de los AA. El fosfato de piridoxal, un derivado de la vitamina B6, actúa como
coenzima en dos de esas reacciones.
1.-
TRANSAMINACIONES
Son reacciones donde se
traspasa el grupo amino desde un a-aminoácido a un a-cetoácido, convirtiéndose
el 1º en a-cetoácido, y el 2º en un a-aminoácido. Las enzimas que catalizan
estas reacciones son las transaminasas y necesitan el piridoxal fosfato (PLP)
como coenzima.
Cuando
predomina la degradación, la mayoría de los aminoácidos cederán su grupo amino
al a-cetoglutarato que se transforma en glutamato (GLU), pasando ellos al
a-cetoácido correspondiente.
Hay
dos transaminasas, GOT y GPT , cuyos
niveles en suero tienen un importante significado en el diagnóstico clínico.
Estas enzimas, abundantes en corazón e hígado, son liberadas cuando los tejidos
sufren una lesión, por lo tanto sus niveles altos en suero pueden ser
indicativos de infarto de miocardio, hepatitis infecciosa, u otros daños
orgánicos.
GPT o
ALAT
Glutamato
+ Piruvato _==================_ -Cetoglutarato + Alanina
GOT o
ASAT
Glutamato
+ Oxalacetato _=================_ -Cetoglutarato + Aspártico
El GLU puede
deshacerse fácilmente del grupo amino mediante una desaminación.
2.-
DESAMINACION OXIDATIVA
El AA pierde el
grupo amino y pasa a a-cetoácido. Esta reacción reversible puede convertir el
GLU en a-cetoglutarato para su degradación, pero también puede sintetizar GLU.
Luego es una reacción que actuará en sentido degradativo o en sentido biosintético
según las necesidades celulares.
3.
DESCARBOXILACIÓN
Los AA se descarboxilan y
forman aminas biógenas, ellas o sus derivados tienen muy importantes funciones
biológicas (hormonas, neurotransmisores, inmunomoduladores, etc): histamina, etanolamina,
serotonina, feniletilamina, etc. Desde la TYR, por descarboxilación y otras
reacciones, se producen la familia de las catecolaminas: dopamina,
noradrenalina y adrenalina. El TRP se descarboxila a triptamina y ésta se
convierte en Serotonina.
REACCIONES GENERALES DE LOS AMINOÁCIDOS
1.TRANSAMINACIÓN: Transaminasa: a-
Cetoglutarato +
AA* _ Glutamato + a-cetoácido*
2. DESAMINACIÓN: Glutamato Deshidrogenasa:
Glutamato + NADPH
_ a-Cetoglutarato + NH4 + +NADP+
3. Fijación de amonio: Glutamina
Sintetasa:
Glutamato+ ATP +
NH4+ _Glutamina + ADP + Pi
4. DESAMINACIÓN: Glutaminasa:
Glutamina + H2O _
Glutamato + NH4+
La reacción 2 es
reversible y cumple una función muy importante para la excreción del ión
amonio. Las reacciones 2 y 3, junto con la 1ª del ciclo de la urea, son las tres
reacciones únicas que pueden realizar los organismos superiores para fijar
un grupo amino a una cadena carbonada y sintetizar nitrógeno
orgánico.
Los grupos ácidos y
básicos pueden neutralizarse mutuamente, constituyendo una sal interna formada
por un ión híbrido (carga positiva y carga negativa), que se llama zwitterión.
Si consideramos un
aminoácido sencillo, éste puede adoptar tres formas iónicas diferentes:
El primer grupo que se
disocia es el carboxilo (pK1 = 2,22). Por la proximidad del grupo NH3+, el COOH
se comporta como un ácido moderadamente fuerte. Si aplicamos la ecuación de
Henderson-Hasselbalch al primer equilibrio de disociación, resulta que a pH
fisiológico (7,4), la concentración de la forma catiónica es prácticamente
despreciable (una de cada 151.000 moléculas en la forma zwitterión). El segundo
grupo en disociarse es el NH3+. Como el pK2 es 9,86, la concentración de la
forma aniónica es muy pequeña en comparación con la forma zwitterión (1
molécula en forma aniónica por cada 300 en forma zwitteriónica). El AA se
comporta a pH fisiológico como un ácido débil que está disociado al 0,35%.
Existe un pH para el cual
la carga eléctrica media de las moléculas es cero. Este pH se llama punto isoeléctrico
(pI). El pI es el pH en el que la molécula se disocia por igual en ambos
sentidos, y como equidista de los dos valores de pK, puede obtenerse por su
semisuma:
PÉPTIDOS
Los péptidos, al igual que las proteínas, están
presentes en la naturaleza y son responsables de un gran número de funciones,
muchas de las cuales todavía no se conocen.
La unión de un bajo número de aminoácidos da lugar a
un péptido, y si el número es alto, a una proteína, aunque los límites entre
ambos no están definidos. Orientativamente:
- Oligopéptido: de 2
a 10 aminoácidos.
- Polipéptido: entre
10 y 100 aminoácidos.
- Proteína: más
de 100 aminoácidos. Las proteínas con una sola cadena polipeptídica se
denominan proteínas monoméricas,
mientras que las compuestas de más de una cadena polipeptídica se conocen
como proteínas multiméricas.
Los péptidos se
diferencian de las proteínas en que son más pequeños (tienen menos de 10.000 o
12.000 Daltons de masa) y que las proteínas pueden estar formadas por la unión
de varios polipéptidos y a veces grupos prostéticos. Un ejemplo de polipéptido
es la insulina, compuesta por 51 aminoácidos y conocida como una hormona de
acuerdo a la función que tiene en el organismo de los seres humanos.
El enlace peptídico es un
enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo
carboxilo (–COOH) de otro aminoácido. Los péptidos y las proteínas están
formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace
peptídico implica la pérdida de una molécula de agua y la formación de un
enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido. Podemos
seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.

Para nombrar un péptido
se empieza por el aminoácido que porta el grupo –NH2 terminal, y se termina por
el aminoácido que porta el grupo -COOH. En el sistema clásico cada aminoácido
se representa por tres letras, y en el moderno, impuesto por la genética
molecular, por una letra. Si el primer aminoácido de nuestro péptido fuera
alanina y el segundo serina tendríamos el péptido alanil-serina, Ala-Ser, o AS.
PROTEÍNAS
En animales superiores, las proteínas son los compuestos orgánicos más abundantes, pues representan alrededor del 50% del peso seco de los tejidos. Desde el punto de vista funcional, su papel es fundamental. No existe proceso biológico alguno que no dependa de la presencia o actividad de este tipo de sustancias; las proteínas cumplen diferentes funciones: enzimas, hormonas, trasportadores, los anticuerpos, receptores de muchas células, etc.
Todas las proteínas contienen carbono, hidrógeno, oxígeno y nitrógeno y casi todas poseen también azufre. Si bien hay ligeras variaciones en diferentes proteínas, el contenido de nitrógeno representa, término medio, el 16% de la masa total de la molécula, lo cual permite calcular la cantidad de proteína existente en una muestra, por medición del N de la misma.
Las proteínas son moléculas poliméricas (poli: muchos; meros: partes) de enorme tamaño; pertenecen a la categoría de macromoléculas, constituidas por gran número de unidades estructurales que forman largas cadenas.
Debido a su gran tamaño, cuando se dispersa a estas moléculas en un solvente adecuado, forman obligadamente soluciones coloidales, con características especiales que las distinguen de las soluciones de moléculas pequeñas.
Por medio de la hidrólisis, las moléculas proteínicas son escindidas en sus monómeros, los aminoácidos. Y cientos o miles de estos aminoácidos pueden participar en la formación de la gran molécula polimérica de una proteína.
Las proteínas resultan de la unión de moléculas de aminoácidos por medio de enlaces peptídicos. Por esto, se pueden clasificar en dos grandes categorías, proteínas globulares y proteína fibrosas.
NIVELES DE LA ESTRUCTURA PROTEICA
LAS PROTEÍNAS SE PUEDEN SEPARAR Y PURIFICAR
Cromatografía:
En todas las separaciones
cromatografías, las moléculas son separadas dentro de una fase estacionaria y
una móvil. Dependiendo del tipo de fase estacionaria podemos distinguir:
cromatografía en papel, cromatografía en capa fina, o cromatografía en columna.
La separación depende de la tendencia relativa de las moléculas en la mezcla de
asociarse con más fuerza a una o a otra fase.






























No hay comentarios:
Publicar un comentario